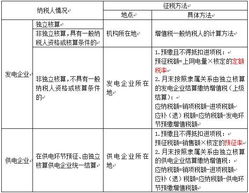
随着全球生物医药产业的快速发展,生物制品的跨境转移日益频繁。对于希望将境外生物制品引入中国市场的内资公司而言,选择合适的注册路径至关重要。根据中国国家药品监督管理局(NMPA)的相关规定,生物制品从境外转移到境内主要有三大注册路径:进口注册、境内生产注册和技术转移注册。以下将详细阐述这三种路径的特点、适用场景及流程。
进口注册路径适用于境外已上市的生物制品直接进入中国市场。该路径要求境外生产企业与中国内资公司合作,由内资公司作为注册申请人,提交完整的注册资料,包括境外临床数据、质量研究、生产工艺等。NMPA将进行技术审评和现场核查,确保产品符合中国的安全、有效和质量标准。优势在于可以利用境外已有的研发成果,缩短上市时间,但需注意数据跨境合规性和本地化临床补充试验的可能要求。
境内生产注册路径涉及将境外生物制品的生产技术转移到中国境内,由内资公司自行生产。此路径适用于希望实现本土化生产的公司,需提交技术转移方案、境内生产设施验证、质量一致性研究等资料。NMPA会重点审核生产过程的合规性和产品与原产国的一致性。该路径有助于降低成本、提升供应链稳定性,但需要投入更多资源在厂房建设、人员培训和质量体系建设上。
第三,技术转移注册路径结合了进口和境内生产的特点,通常适用于境外企业与内资公司合作,通过技术许可或合资方式实现产品转移。注册时需提供技术转移协议、知识产权证明、以及境内外的对比研究数据。该路径灵活性高,可以加速产品本土化进程,同时规避部分进口壁垒,但需妥善处理技术保密和权益分配问题。
内资公司在选择生物制品境外转移的注册路径时,应综合考虑产品特性、市场策略和资源能力。进口注册适合快速上市,境内生产注册有利于长期本土化,技术转移注册则提供了合作共赢的中间方案。建议企业在决策前咨询专业法规机构,确保合规高效地完成注册流程,推动生物制品在中国的成功落地。